
一、背景
2015年執行新國標,許多行業排放標準COD<80mg/L,生物處理難以達到,出水溶解性COD在130 – 170 mg/L左右。2018年以來,各地政府為了貫徹“水十條”精神,嚴控排污,紛紛將城鎮污水處理廠排放要求提高到IV水標準。故深度處理是形勢所迫,研討相適應的深度處理技術十分必要。
二、臭氧應用于深度處理的優勢
對比— Fenton法產泥量大、鹽度大
●形成FeOOH沉淀,產泥量應在400g/M3,是城市污水廠的三倍!且無熱值。折合水成本:約1.00 元/ M3.水。
●污泥熱值低,焚燒困難;屬工業廢物,不能填埋。
●殘余700mg/L 硫酸根( III級地表水標準是250)不利于水體自凈。
●發生厭氧,產生硫化物,危害極大!
優勢 — 催化臭氧,異相催化,清潔、綠色
●pH中性條件下,利用鐵的化合物催化,不使用藥劑,不產泥,不殘留鹽。
機理 — 產生·OH,徹底氧化有機物
●文獻報道,對于大部分有機物,O3與·OH,反應速度差 107 –109 倍。
條件 — pH 中性,FeOOH催化
關于Fe0 、Fe2+催化,在深度處理中屬偽命題:Fe2+與O3反應,不是催化劑;
pH 中性條件, Fe3+完全沉淀,而Fe(III)是催化劑;
與 O3發應的過渡金屬,并不一定都是催化劑:臭氧在氧化很多金屬單質時,并不產生·OH。這種情況同樣說明:臭氧存在著不產生·OH的無效分解;估計熱分解也屬于這種情況。
高級氧化規律 — Fe2+催化H2O2 ;Fe(III) 催化O3
依據:過程金屬的化合物是臭氧催化劑。
三、臭氧氧化的應用
臭氧性質
●易分解:大氣中,20 ~ 30 min;水體中,5 ~ 20 min ;且受溫度影響巨大,100 ℃時,分解劇烈。
●易溶解:是O2的 13倍;比重大:是空氣的1.66倍。
●濃度低:以純氧源臭氧發生器, O3為 160、 O2 為 2100 mg/L;而大氣中氧氣為310mg/L;符合亨利定律。
污水處理中臭氧工藝有以下特點:
水中臭氧濃度低,利用率(含無效分解)遠高于氧氣;充氧理論不適宜描述臭氧傳質;臭氧尾氣處理,并非關鍵。
臭氧在給水處理領域的應用
●消毒:氧化細胞內酶;破壞DNA、RNA物質;透過細胞膜使之發生通透性畸變。
●給水預處理:去除色、嗅、味。破壞發色基團中不飽和鍵(芳香基或共軛雙鍵),氧化鐵、錳等顯色離子;氧化水中還原性物質。
●臭氧-生物活性炭處理:臭氧起破壞大分子和充氧作用,有機物的降解主要是生物活性炭。
臭氧在工業廢水預處理中的應用
●去除酚、氰、硫氰等易氧化的有機物;
●脫色:印染、染料廢水用臭氧氧化法脫色;
●烯烴氧化:臭氧可破壞 C=C 雙鍵轉變為羰基。
●局限性:O3 分子態的直接氧化,產物為小分子羧酸、酮和醛類等,很難徹底礦化為CO2、H2O
●O3 預處理參數:停留10- 20min;投加量 20- 50mg/L。
四、臭氧形成高級氧化的途徑
臭氧在水中反應途徑
v直接臭氧反應:污染物 + O3 → 產物或中間物
有選擇性,速度慢;氧化不徹底。
v自由基反應:污染物 + ·OH → 產物或中間物
無選擇性, ·OH ( E0=2.8 V ) 電位高,反應能力強,速度快,可引發鏈反應,使許多有機物徹底降解。
●文獻:大部分有機物,兩者反應速度差 107– 109 倍。
根據有機物在O3分解產生·OH 作用,對自由基鏈式反應,可以分為兩大類:
●促進劑:不與O3反應,與·OH反應生成自由基;如,甲醇、糖類、甲醛及天然有機物;
●抑制劑:與·OH反應不產生自由基,如,叔丁醇。
●大量實踐表明:生化出水O3直接臭氧氧化,COD去除率20%左右。
O3形成高級氧化法途徑
機理:形成高級氧化機制與H2O2不同,產生·OH途徑(1)堿性條件;(2)物理誘導;(3)催化劑催化。
●堿性條件pH>10下可產生·OH 。條件是不存在HCO3-/CO32- 平衡的影響;
●O3-H2O2:極少量H2O2即可大大強化O3在中性條件下產生·OH ,可形成實用工藝;
●O3-超聲、 O3-微波:有作用,但效率很低,工程實施難,意義不大;
●O3-UV:可誘導持續形成·OH,對生化處理出水,其色度和濁度均很低,該方法有實用價值。
關于O3-活性炭:活性炭有催化效果,但作用不大。有報道,其表面胺基化后,催化效果明顯提高。
O3 高級氧化催化劑
在中性條件下,催化O3形成·OH ;
●過渡金屬氧化物和化合物:MnO2、TiO2、 NiO、CoO 、Fe2O3、FeOOH等,有良好的催化效果;
●Al2O3為載體:上述金屬化合物負載在Al2O3上,也有少數文獻報道負載單質金屬Cu、Ni等;
●同相催化:有報道,Fe2+、Mn2+、Co2+、Ni2+等有催化作用,但效果甚微。
其中價廉、無害的Fe、Mn、Ti等單質和化合物倍受關注
關于Fe2+的催化:
O3 + Fe2+ → FeO2++ O2
FeO2+ + H2O → Fe3++ •OH + OH-
FeO2+ + Fe2+ + H+→ 2Fe3+ + H2O
●Fe2+參加了反應,不是催化劑;
●pH中性條件, Fe3+發生完全沉淀,Fe(III)是催化劑。
●同理:Fe(0)在氧化環境中被氧化Fe(III)。
因此,Fe0 、Fe2+是催化劑在深度處理實踐中屬偽命題。
五、催化臭氧的鐵基催化劑
●Fe常見金屬元素,單質和氧化物、水解物無毒無害;
●Fe(0) 性能活潑,表面易形成化合物;其氧化物、水解產物在工業界大量存在。
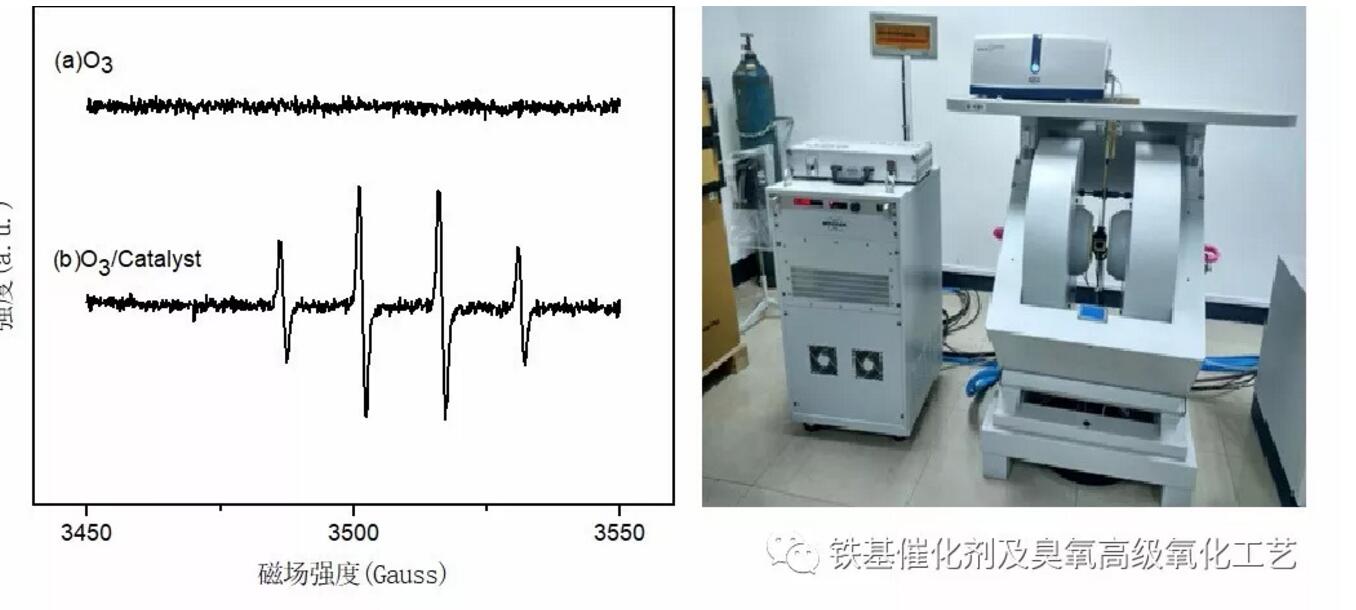
●雖然Fe2O3和Fe3O4都可以作為催化劑,但根據異相催化機理:表面羥基是催化O3的主要活性點。因此,鐵的羥基氧化物,如 FeOOH 催化性能更好。
某些晶型的羥基化物,著名的有γ-FeOOH,有較強的催化O3活性;
發現了更有效鐵基復合催化劑!
優勢:
●材料同質:Fe(X)/Fe(M)、Fe(X)/Fe(X) ;
●損耗產物Fe(III) 有益無害,可作為吸附劑;
●價格低廉、來源廣泛。
1、一種焙燒改性鐵基催化劑
● 制備方法:鐵礦石球磨、加木屑無氧焙燒。表面經改性,生成有催化功能的鐵的氧化物和帶有催化功能的碳基化合物。
● 特點:有固定形狀,便于工藝應用,催化效果一般。
發明 授權:“一種工業廢水深度處理的催化臭氧氧化方法”
2、Fenton法分步沉淀制備鐵基催化劑
●方法:Fenton法氧化后,控制不同的pH值、在適宜溫度下分二步沉淀,制備出催化劑。
●特點:廢物利用,催化效率一般,制備條件不易控制。
發明 :“污水深度處理芬頓法污泥的資源化利用方法”
3、精細化工業廢渣制備鐵基催化劑
● 制備方法:使用化工廢渣,控制pH值、ORP、溫度分布沉淀,提取含有Fe、Co等有效成分,制備出催化劑。
● 特點:廢物利用,催化效率高;需后續分離單元。
發明 :“一種紅土鎳礦中和廢酸后制備臭氧氧化催化劑 γ-FeOOH的方法”
4、合金鋼鐵屑改性制備鐵基催化劑
n 制備方法:選定特定合金鋼,經化學改性,表面形成Fe、Mo、Ni、Mn等化合物的催化成份。
n 特點:催化效率高,有利于工程實施;
上述研究成果—— 已申請 十項,授權四項。
對多種工業廢水的實驗研究結果
改性鐵屑催化臭氧氧化,對兩種實際煤化工廢水的處理效果工程可達到:
COD去除率60%以上,出水 COD在 60mg/L以下;
參數:停留時間 40 - 60min;O3 : COD = (1 ~ 1.2): 1
盡管氧化劑費用會高些,但避免了大量產泥。
處理對象為某印染行業生化處理出水,生產性所得運行參數:
進水:COD 130 – 170 mg/L,
工況1:t = 30 min, O3 :rCOD = 1.0
出水 COD在 60 mg/L以下;
工況2:t = 45 min, O3 :rCOD = 1.2
出水 COD在 50 mg/L以下;
產生 TFe約在 20 mg/L左右。
應用于精細化工園區深度處理:當水力停留時間為 45min時,COD去除率在49 – 55%之間,達到了預期目的。
綠色工藝,應用價值高!
六、催化臭氧氧化工藝特點
三相反應:高級氧化發生在催化劑表面;故要求有一定的水力停留時間和水流紊動強度。
反應器形式:塔式(鋼結構),折流式(土建結構);
停留時間:20 ~ 180 min,隨水質與前端處理工藝不同變化范圍很大,由小試決定;
回流比:塔式可不回流,折流式 1 ~ 3倍;
臭氧需要量: O3 : rCOD = 1.0 ~1.6 。
錯誤的說法: O3分子中只含一個活性O ,故質量比為:
O3 : rCOD = 3 : 1
理論與實踐均證明是錯誤的!
O3 形成·OH 當量:每 3分子的O3可生成 2分子·OH ;
·OH氧化有機物:·OH相當于2O2氧化當量。
由此:3分子O3相當于4分子O2 氧化當量,即質量比:
O3 : rCOD = 1.125
上述是 很大的理論比,與本課題組的實踐很接近。
關于 pH 和堿度影響
● pH 值變化:反應過程中pH值均下降,原因有二:消耗了OH- ;氧化產生有機酸;這與零價鐵化學還原pH 變化趨勢完全相反。
● 初始 pH值影響:資料表明,CO32-比HCO3-/有更強的捕獲·OH ,而污水中均存在著HCO3-/CO32- 平衡,故一般工業廢水在弱酸性條件下比堿性條件好。
● 當廢水堿度高,堿度( CaCO3計)比 COD 之值大于10時,催化臭氧氧化的效果受到較大的影響。
● 其它陰離子,如Cl- 、SO42- 、NO3- 沒有明顯影響。
● 水溫影響很大,尚未做系統研究,工程意義不大。
關于 COD與 TOC的去除規律
● 催化氧化過程中,COD去除趨勢波動,而 TOC去除趨勢平穩;
● 催化后,幾乎所有廢水TOC的去除率提高幅度更大;
● 加·OH抑制劑后,對 TOC去除率影響更大。
事實說明:O3直接氧化,更多的是轉化了有機物,徹底氧化有機物的比例較小;而催化O3氧化,能去除更多種類的有機物,對保護環境和生態健康有著更重要的意義。
高級氧化及二次生化性分析
生化降解有機物規律:大分子有機物難降解,小分子有機物易吸收、降解,如:乙酸、乙醇等;
高級氧化有機物規律:大分子有機物容易氧化,小分子有機物難以氧化,如:乙酸、丙酮等;
生化出水中的有機物,難以生物氧化與還原,也不再有化學活性較高的官能團,故不太可能氧化的中間產物為毒害有機物。
理論分析:經催化臭氧氧化,其可生化性得到提高;二次生化工藝是可行的。
目前工業園區廢水常見不達標的水質指標有:COD、總氮(TN)
某工業廢水深度處理高級氧化后,嘗試生物反硝化,結果發現:由于有機物受限,總氮去除率并不高,但殘余有機物去除率很高,可達70%左右。間接證明:“二次生化”可行!
鐵基催化劑的催化功能
鐵基催化劑不僅能催化O3形成·OH ,且可有效地催化O2 ;
催化后 O2氧化能力大幅提高,比 O3直接氧化,COD的去除率還要高。
鐵基催化劑的填料功能
O3在催化劑表面才能有效分解,產生·OH,比表面積大,產生·OH量大;
·OH存活期為納秒級,只能“就近”氧化有機物,比表面積越大,距離越近。
因此,比表面積極大地影響催化臭氧反應。
總結:鐵基催化劑的優勢
pH 中性條件下,利用鐵的羥基氧化物催化,不使用藥劑,不增加鹽度,臭氧徹底分解;
優勢 — 異相催化,不產生污泥,沒有二次污染;
特征 — 清潔、綠色、高效。

來源 馬魯銘老師 鐵基催化劑催化臭氧公賬號
標簽:臭氧氧化(12)催化(3)鐵基(1)催化劑(1)
相關文章:













